Профилактические меры
Для ограждения себя от развития дисплазии, женщине нужно выполнять ряд определенных правил:
- придерживаться здорового, активного образа жизни;
- своевременно лечить заболевания репродуктивной системы;
- поддерживать психологическое равновесие и постоянную половую жизнь;
- отказаться от ВП;
- исключить факторы, способные привести к сбою гормонального фона;
- контролировать свой вес, проводить профилактику ожирения;
- ежедневно выполнять ряд умеренных физических упражнений или заняться каким-либо видом спорта;
- питаться полноценно, сбалансировано;
- не пренебрегать профилактическими визитами к гинекологу;
- проводить мероприятия по укреплению иммунитета.
Каждая женщина должна периодически самостоятельно обследовать свою грудь, следить за правильным окрасом кожного покрова, и отсутствием патологического увеличения лимфатических узлов.
Для всех представительниц слабого пола грудь является ее гордостью и органом вскармливания будущего ребенка
Поэтому очень важно следить и поддерживать здоровье молочной железы. Здоровый образ жизни и своевременное обращение за помощью к медицинскому работнику поможет оградить женщину от дисплазии или провести нужное лечение для полного выздоровления
Клиническая картина
Первыми клиническими проявлениями АПЖК служат желудочковые аритмии, возникающие чаще всего при физических нагрузках и выявляемые в основном у подростков или молодых людей, реже в детском возрасте. У 29% больных АПЖК они проявляются синкопальными состояниями (обмороками), а у 7-23% больных — остановкой кровообращения.
При невысокой ЧСС больные могут ощущать лишь чувство сердцебиения. При частоте желудочковой тахикардии свыше 150-160 в минуту, помимо ощущения сердцебиения, нередко возникают головокружения, обмороки, падение АД (аритмогенный коллапс). Приступ желудочковой тахикардии с очень высокой частотой (200 в минуту и более) может трансформироваться в фибрилляцию желудочков и закончиться внезапной сердечной (аритмической) смертью.
Мономорфная желудочкова тахикардия с Экг-картиной блокады левой ножки пучка Гиса является наиболее частой желудочковой аритмией. Однако могут наблюдаться и другие желудочковые аритмии, начиная от бессимптомной желудочковой экстрасистолии до полиморфной желудочковой тахикардии с тяжелыми гемодинамическими расстройствами
Дисплазия шейки матки 3 степени — это рак?
Цервикальная дисплазия (плоскоклеточное интраэпителиальное поражение шейки матки) – это патологический процесс, предшествующий раку РШМ.
Болезнь развивается на фоне атипической трансформации (опухолевого перерождения) резервных ростковых и базальных клеток эпителия слизистой шейки матки.
 Эпителий слизистой оболочки шейки матки в норме – схема строения
Эпителий слизистой оболочки шейки матки в норме – схема строения
Атипичные базальные клетки теряют способность к созреванию, дифференцировке и упорядоченному росту. Структура поражённого эпителия разрушается. Слизистая утрачивает свои физиологические функции и вовлекается в опухолевый процесс.
На ранних этапах дисплазия включает не больше нижней половины эпителиального пласта. Клеточная атипия носит лёгкий (CIN 1) или умеренный (CIN 2) обратимый характер.
На третьем этапе (CIN 3) анаплазия захватывает практически всю толщу слизистой.
Опухолевая трансформация атипичных клеток принимает злокачественный характер. Они размножаются так быстро, что окончательно «выталкивают» собой здоровые.
 Степени дисплазии шейки матки
Степени дисплазии шейки матки
Третья, она же тяжёлая степень дисплазии трудноотличима от преинвазивного рака шейки матки car in situ. Она представляет собой промежуточное звено между предраком и истинным цервикальным раком.
В современной классификации тяжёлую дисплазию объединяют с внутриэпителиальным или преинвазивным раком «на месте» (рак in situ, carcinoma in situ) и обозначают CIN 3.
От настоящего инвазивного рака дисплазию CIN 3 «отделяет» лишь целостность базальной мембраны. Как только скорость размножения (пролиферация) озлокачествленных клеток превысит скорость их естественной гибели, они разрушат этот тонкий барьер.
Врастая в соседние ткани, проникая в кровеносные сосуды, метастазируя в лимфатические узлы, раковый процесс охватит своими «щупальцами» весь организм.
Одни авторы не согласны с отождествлением дисплазии третьей степени с раком in situ. По их мнению, тяжёлая дисплазии – это всё-таки предрак. А рак «на месте» — уже рак 0 стадии (TisN0М0), но без признаков инвазии.
Другие считают логичным объединить оба этих этапа опухолевого процесса в единый класс CIN 3.
Ведь на фоне тяжёлой дисплазии гистологически часто выявляются очаги рака in situ, а иногда и локусы инвазивного роста (микроинвазивного РШМ стадии Т1а). К тому же по краям участков рака in situ обнаруживаются зоны дисплазии различной степени выраженности (от тяжёлой до лёгкой и умеренной).
Читать подробнее: Рак шейки матки 1 (первой) стадии – прогноз, лечение и симптомы
Дисплазия ШМ 3 степени — код по МКБ-10
N87.2 Тяжёлая дисплазия шейки матки, неклассифицированная в других рубриках.
Цервикальная интраэпителиальная неоплазия тяжелой степени (CIN3) без других указаний
D06 Карцинома in situ шейки матки.
Цервикальная интраэпителиальная неоплазия (CIN) 3 степени с упоминанием о резко выраженной дисплазии
Причины перехода умеренной дисплазии в третью степень
- Длительная персистенция папилломавирусной инфекции (в особенности высоко-онкогенных типов ВПЧ 16, 18, 45, 31, 33) в эпителии шейки матки
- Накопление мутаций (поломок генома), углубляющих атипичные изменения в клетках
- Сопутствующие урогенитальные инфекции, в том числе ИППП (хламидии, трихомонады, вирус герпеса 2 типа, др.), бактериальный вагиноз (уреаплазмоз, гарднереллёз, др.), цервицит. Хроническое воспаление делает слизистую уязвимой для ВПЧ, способствует снижению иммунитета, накоплению «поломок» в хромосомных ДНК
- Устойчивое снижение местной иммунной защиты
- Недостаток влияния гормонов-эстрогенов на слизистую
- Табакокурение
Способность онкогенных типов вируса папилломы (ВПЧ 16, 18 и др.) вызывать опухолевую трансформацию клеток шеечной оболочки научно доказана.
Основной путь передачи ВПЧ – половой. Попав во влагалищную среду, вирус инфицирует только незрелые, активно размножающиеся (резервные ростковые и базальные) клетки.
Он «добирается» до глубокого базального слоя через повреждения на слизистой. «Легкой добычей» для ВПЧ становятся ростковые и метаплазированные клетки зоны трансформации (ЗТ) – они лежат буквально на поверхности тонкого переходного эпителия. Вот почему большинство дисплазий берёт начало в переходной зоне (ЗТ), в местах эктопии (ложной эрозии) и воспаления (истинной эрозии).
Многолетняя персистенция вируса способствует интеграции (встраиванию) вирусной ДНК в геном заражённой клетки. Это и приводит к постепенному развитию злокачественной атипии.
 Варианты течения ВПЧ-инфекции – схема
Варианты течения ВПЧ-инфекции – схема
Лечение аритмогенной дисплазии правого желудочка
- Антиаритмические средства (в первую очередь β-блокаторы).
- Хирургическое лечение: криодеструкция артимогенного очага или вентрикулотомия.
Первые методы лечения аритмогенной дисплазии правого желудочка — хирургические методы. Так в 1982 г. Guiradon выполнил частичную вентрикулотомию в зоне наиболее ранней эпикардиальной активации. В качестве модификации этой операции в последующие годы предложена операция полной изоляции свободной стенки правого желудочка и методика с частичной изоляцией свободной стенки ПЖ. Однако операции не нашли широкого распространения из-за частых рецидивов желудочковых нарушений ритма и развития правожелудочковой недостаточности.
Нарушения ритма при аритмогенной дисплазии правого желудочка зависимы от катехоламина, что определило использование бета-блокаторов для подавления нарушений ритма и их профилактики.
Применение соталола приводит к эффективному подавлению нарушении ритма у 83% больных АДПЖ, в то время как эффект верапамила — 50%, а амиодарона — всего 25%. На основании этих данных рекомендовано использовать соталол у больных с аритмогенной дисплазией правого желудочка средней тяжести течения и с бессимптомным течением. Клиническая эффективность антиаритмических препаратов для первичной профилактики внезапной смерти не изучена. Факт приема антиаритмических препаратов приводит к снижению ежегодной смертности у больных с желудочковыми тахикардиями до 0,08%. При присоединении поражения Левого желудочка эффективность антиаритмических препаратов резко снижается, а риск внезапной смерти возрастает.
По мнению экспертов, использование соталола эффективно и в рамках первичной профилактики внезапной смерти и эффективного контроля частоты желудочковых нарушений ритма. Более того, при отсутствии эффекта при приеме соталола не следует подбирать дальше антиаритмические препараты, а ставить вопрос о немедикаментозном лечении. Соталол доказал свою эффективность и у больных с кардиовертером-дефибриллятором, приводя к меньшей частоте срабатывания дефибриллятора. Появление клинических признаков недостаточности кровообращения требует использования всех классов препаратов, применяемых в лечении ХСН.
Можно предполагать эффективность спиронолактонов у больных аритмогенной дисплазией правого желудочка, однако клинические исследования доказательства их эффекта отсутствуют.
Выбор объема физических нагрузок, безопасных для больного АДПЖ, требует от врача большого искусства, так как желудочковые тахикардии у больных АДПЖ индуцируются физическими нагрузками. В связи с этим любая чрезмерная нагрузка, подвижные виды спорта, спорт больших достижений противопоказаны этим больным
Объем обычных нагрузок подбирают при велоэргометрическом тестировании, выполнение которого требует осторожности, так как оно может спровоцировать желудочковую тахикардию
Пациентам с высоким риском внезапной смерти показана установка кардиовертера-дефибриллятора, которая показана больным:
- с успешной реанимацией по поводу остановки сердца;
- с синкопальными эпизодами;
- с жизнеугрожающими желудочковыми аритмиями, не поддающимися медикаментозной блокаде;
- больным АДПЖ, у которых смерть прямых родственников наступила внезапно.
Эффективность катетерных методов лечения нарушений ритма У больных аритмогенной дисплазией правого желудочка зависит от успешности идентификации критической зоны в миокарде ПЖ. Часто после абляции желудочковые тахикардии становятся чувствительными к антиаритмическим препаратам. Катетерную абляцию используют как метод первичного лечения, а также у больных с кардиовертером-дефибриллятором, что позволяет сократить число его срабатываний и улучшить качество жизни больного. При выраженной бивентрикулярной недостаточности возможна трансплантация сердца.
Современный уровень знаний позволяет прийти к заключению: для больных с аритмогенной дисплазией правого желудочка соталол — препарат первого выбора. Это лечение может остаться успешным на многие годы. Появление синкопе, или снижение эффективности соталола, или эпизод остановки сердца (особенно у лиц с семейным характером заболевания) — показания к установке кардиовертера-дефибриллятора. Катетерная абляция — вспомогательный метод лечения, в том числе и у больных с кардиодефибрил-лятором. Прием соталола целесообразно продолжить и при наличии кардиовертера-дефибриллятора.
Ампутация шейки матки — в каких случаях и как часто применяется?
В сравнении с конизацией, ампутация (от лат. amputare – усекать, отсекать, удалять) шейки матки – более травматичная и объёмная операция.
В случаях цервикальной дисплазии ампутацию применяют тогда, когда полноценную конизацию сделать невозможно. Например, из-за значительной деформации шейки матки или сочетанной с дисплазией шеечной патологии.
Операция проводится в стационаре, как правило, под общим наркозом.
Режущим инструментом обычно бывает хирургический скальпель. Но могут применяться электохирургические или ультразвуковые методики.
- Клиновидная ампутация по Шредеру
- Ампутация по Штурмдорфу
Клиновидная ампутация шейки матки
- Изолированная элонгация шейки матки
- Атрофическая деформация ШМ в пожилом возрасте
- Травматическая деформация (разрывы после родов, послеоперационные травмы, эктропион, др.)
- Гиперплазия поражённых шеечных желёз в подслизистом слое ШМ
Суть оперативной техники
Намеченную к удалению часть шейки матки рассекают на две половины. Из полученных одной или обеих частей шейки вырезают клиновидный участок, включающий зону поражения в пределах здоровой ткани.
Оставшиеся лоскуты сшивают между собой отдельными швами так, что в результате слизистая цервикального канала смыкается с образованием нового наружного зева (отверстия).
 Клиновидная ампутация шейки матки
Клиновидная ампутация шейки матки
Технику такой ампутации впервые предложил немецкий врач акушер-гинеколог Карл Шредер ещё в ХІХ веке. С тех пор операция носит его имя.
Конусовидная ампутация шейки матки
- Те же, что при клиновидной ампутации
- Обширное аномальное поражение влагалищной части ШМ
- Обширное аномальное поражение цервикальной слизистой внутри канала
- Неясная картина поражения с подозрением на инвазивный злокачественный процесс
В сравнении с клиновидной, конусовидная ампутация носит более радикальный характер.
- Низкую конусовидную ампутацию ШМ – в этом случае удаляется «макушка» наружной части шейки матки
- Среднюю
- Высокую – предполагает ампутацию конусовидного фрагмента шейки матки по всей длине цервикального канала, вплоть до внутреннего зева тела матки
Высокую ножевую конусовидную ампутацию рассматривают хорошим вариантом органосохраняющего лечения преинвазивного (ТisN0M0) и микроинвазивного (Т1аN0M0) рака шейки матки у женщин детородного возраста.
Суть оперативной техники
Отступив 5-10 мм от границы области поражений, делают круговой разрез слизистой шейки. При этом слизистую несколько отделяют скальпелем от мышечной ткани.
Затем разрез на шейке углубляют в толщу по направлению цервикального канала. Вырезают и вынимают конусообразный сегмент.
В завершение «натягивают» отсепарированную ранее слизистую на раневую поверхность, оставляя свободным просвет цервикального канала и формируя «новую» шейку. Рану на шейке ушивают отдельными или модифицированными швами.
 Конусовидная ампутация шейки матки по А. Штурмдорфу
Конусовидная ампутация шейки матки по А. Штурмдорфу
Технику конусовидной ампутации ШМ разработал американский гинеколог А. Штурмдорф в начале ХХ века. Изначально её проводили для лечения гипертрофии и хронического воспаления влагалищной части шейки матки.
В настоящее время обе вышеописанные операции в лечении тяжёлой дисплазии имеют второстепенное значение и применяются ограничено.
Высокая ампутация
Высокая ампутация шейки матки – полное удаление шейки до границ внутреннего зева матки с иссечением верхнего отдела влагалища.
 Объём оперативного вмешательства при высокой ампутации шейки матки
Объём оперативного вмешательства при высокой ампутации шейки матки
- Совмещённая патология шейки на фоне здорового тела матки
- Распространение дисплазии на своды влагалища
Высокая ампутация ШМ – серьёзная лечебно-реконструктивно-пластическая операция.
Проводится: — в клиническом стационаре;
— под общим или эпидуральным наркозом;
— влагалищным или комбинированным с лапароскопией доступом.
Несмотря на максимальный объём удаления шейки, эта органосохраняющая хирургическая методика оставляет женщине возможность вести полноценную интимную жизнь, зачать, выносить и родить ребёнка.
Лечение болезни Фонтана
Учитывая две главные опасности патологии – аритмию и сердечную недостаточность,  врачи применяют 2 направления терапии:
врачи применяют 2 направления терапии:
-
- назначаются антиаритмические препараты для предотвращения желудочковой тахикардии: соталол, амиодарон или флекаинид;
- при сердечной недостаточности применяются карведилол, ингибиторы АПФ, при отеках – диуретики, антагонисты альдостерона.
При выраженном замедлении пульса, в том числе вызванном приемом антиаритмических препаратов, возможна установка кардиостимулятора. Это устройство поддерживает сокращения сердца при замедлении пульса.

При неэффективности медикаментозной терапии может быть установлен кардиовертер-дефибриллятор или выполнена радиочастотная абляция источника желудочковой тахикардии. Последний вариант используется достаточно редко, так как его эффективность именно при этом заболевании невысока.
Кардиовертер-дефибриллятор устанавливают пациентам с расширением и снижением сократимости правого желудочка, вовлечением левого желудочка, наличием желудочковых тахикардий (по данным ЭФИ или ХМ ЭКГ). Это устройство обычно имплантируют молодым людям, и оно практически в 100% случаев помогает предотвратить у них внезапную смерть, вызванную приступом аритмии.
У больных, имеющих тяжелые нарушения ритма в сочетании с выраженной сердечной недостаточностью, проводится операция вентрикулотомия. Во время вмешательства происходит анатомическое прерывание путей, по которым идет аномальное возбуждение сердца при аритмии.
Наиболее эффективна трансплантация сердца, но эта операция выполняется редко.
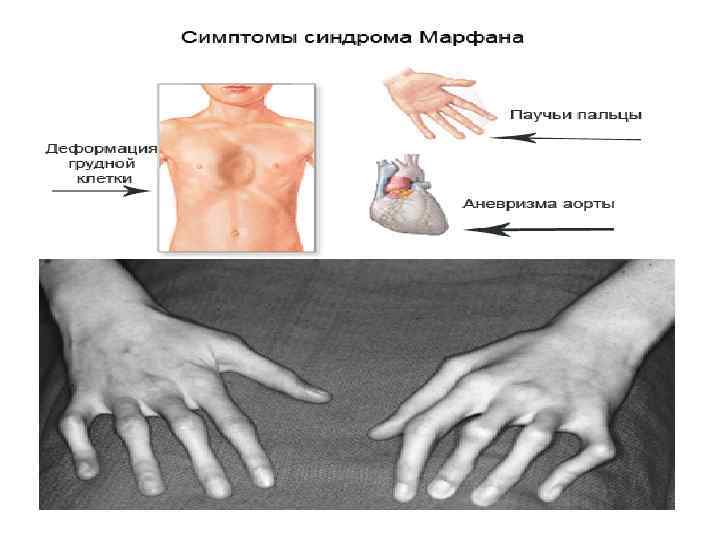
Вся причина в белке. Гуттаперчевые дети.
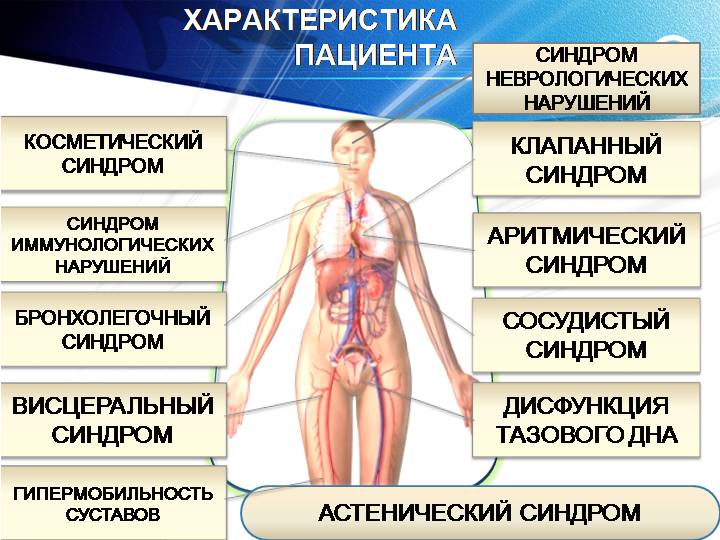
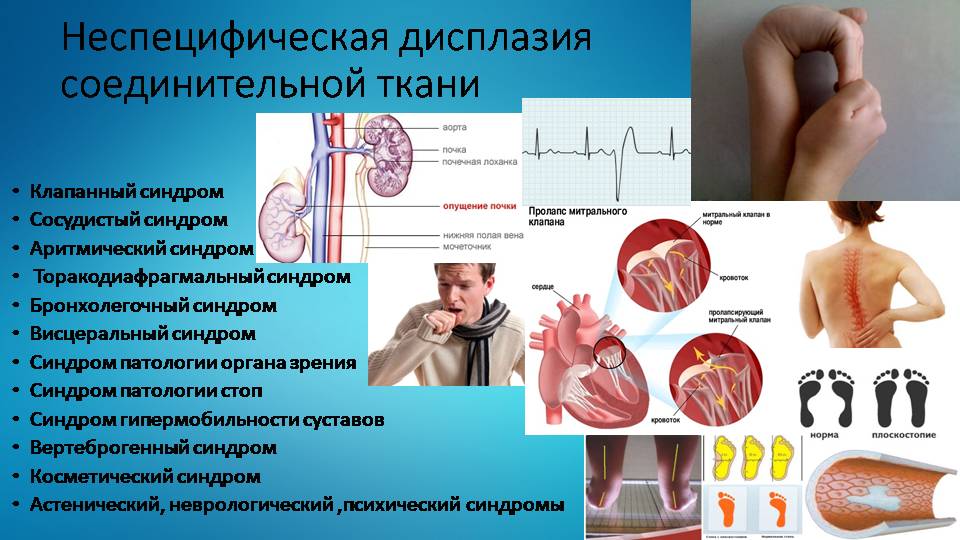
Дисплазия соединительной ткани – это генетически обусловленное состояние, которое характеризуется дефектами волокнистой структуры и основного вещества. Состояние не является отдельным заболеванием и не вписано в МКБ-10. Дисплазия (от греч. δυσ — нарушение + πλάθω — образую) приводит к деформации формы и структуры органов и систем, имеет:
- проградиентное развитие (с течением времени количество и выраженность симптомов нарастает);
- разнообразие клинических проявлений;
- аномальную реакцию на действие и распределение лекарственных препаратов.
Все перечисленные факторы затрудняют диагностику и лечение аномалии. Поэтому сегодня синдром дисплазии соединительной ткани детей является проблемой, в решении которой участвуют специалисты различных областей медицины и ученые – физиологи, генетики, гистологи, биохимики.
Соединительная ткань представляет собой определенным образом организованную жестко-эластичную «сеть» из клеток волокон коллагена с включением в нее структурных белков, белково-углеродных комплексов и массы разнородных специфических клеток. Благодаря такой организации ткань выполняет сразу несколько функций в организме:
- опорную;
- защитную;
- транспортную;
- соединительную/разграничительную.
При дисплазии нарушается синтез и пространственная организация главного белка соединительной ткани – клеток коллагена. Из-за мутации генов в клетках, кодирующих его синтез и построение многомерной структуры, а также генетических нарушений структур, содержащих информацию о специальных ферментах и их «веществах-помощниках» – кофакторах, происходит ослабление механической прочности ткани и нарушение ее эластичных свойств.
Процесс нарушения функций растянут во времени. Поэтому признаки дисплазии соединительной ткани детей проявляются в разном возрасте. Некоторые признаки появляются на первом году жизни, а другие, например, торако-диафрагмальный синдром, в младшем школьном возрасте и в пубертате. Максимальная выраженность синдрома приходится на возраст 14-18 лет, что связанно с бурным ростом и половым созреванием подростков.
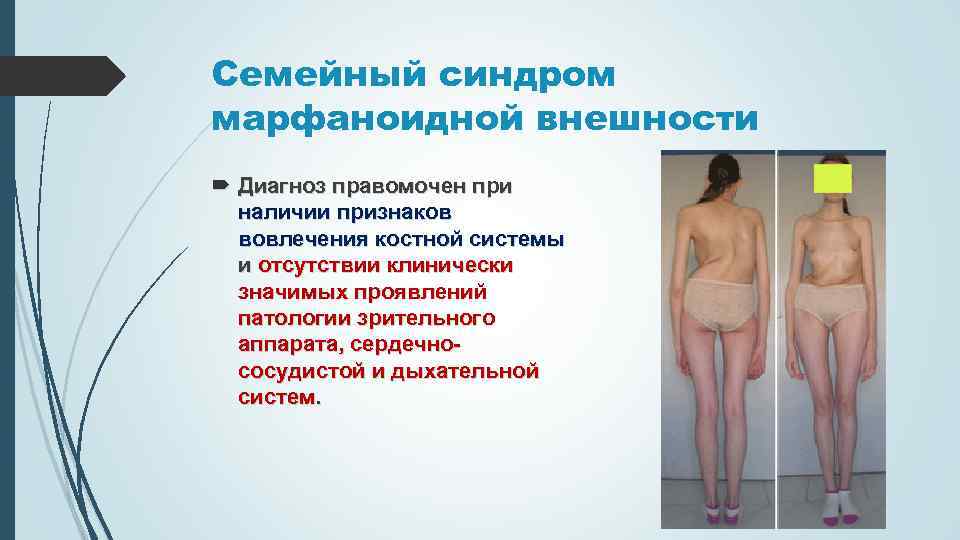
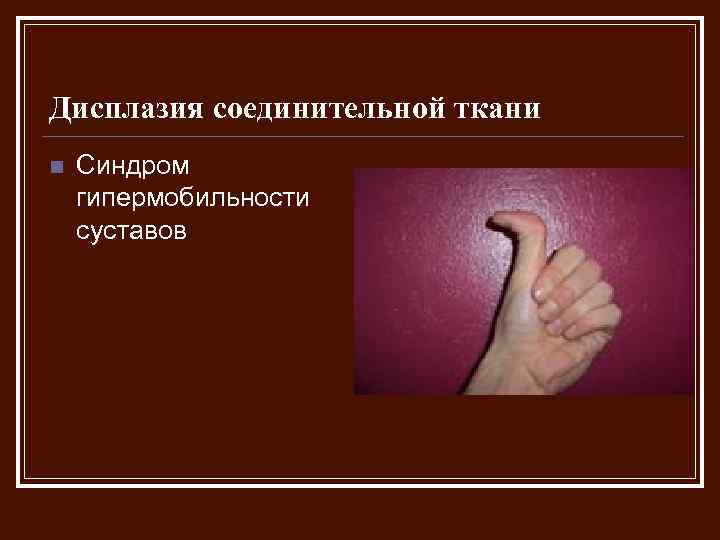
Дети с дисплазией соединительной ткани, например костно-мышечной системы имеют специфический внешний вид – вогнутую в виде воронки грудную клетку, «гуттаперчевые» суставы, астеническое строение тела. В раннем возрасте им могут ставить диагноз: рахит, синдром патологии стопы (продольное плоскостопие) или дисплазия тазобедренных суставов. У детей старшего возраста диагнозы не менее разнообразны – от варикоцеле до варикоза и заболеваний ЖКТ. И только у незначительного (менее 3-4%) количества детей специалисты смогли поставить верный диагноз. Почему так происходит?
Инструментальные методы исследования
Единой методики для постановки диагноза АДПЖ не существует, потому применяют полный комплекс исследований.
При проведении электрокардиограммы выделяют несколько диагностических признаков:
- инверсии T-волн в V1-V3 — незначительный диагностический критерий, но одна из наиболее распространенных аномалий ЭКГ присутствует у 85% пациентов с АДПЖ;
- длительность QRS = 110 мс в V1-V3;
- эпсилонная волна (электрические потенциалы после окончания комплекса QRS) — важный признак, наблюдается в 30% случаев АДПЖ.
К малым признакам АДПЖ относятся:
- Выявленные при холтеровском мониторинге частые желудочковые экстрасистолии — чаще 1000 раз в сутки. Нарушение реполяризации в сегментах V1-V3 в возрасте старше 12 лет. Тахикардии с блокадой левого пучка Гиса.
- Гистологическое обследование показывает, что количество жировой ткани превышает 3%, а в биоптате обнаруживается лимфоцитарная инфильтрация.
- Регистрируется дилатация правого желудочка со снижением выброса.
Электрокардиографические изменения происходят из-за тканного перерождения миокарда, появлением неоднородности и появлением условий для желудочковых тахикардий. Механизм аритмии — повторный вход волны деполяризации (возбуждения клеток). С помощью холтеровского мониторинга можно выявить дисфункции ритма на субклинической и развернутых стадиях. При наличии слабости, головокружения, одышки и обмороков обычно регистратор ЭКГ фиксирует устойчивые и неустойчивые тахикардии.
При желудочковых тахикардиях и экстрасистолах электрическая ось сердца отклоняется вправо или влево, происходит блокада левой ножки пучка Гиса. Аритмогенный очаг может находиться в верхушке или у основания правого желудочка, что влияет на характер кривой электрокардиограммы.
Используются методы визуальной оценки состояния миокарда.
Эхокардиография неинвазивная техника визуализации, которая используется чаще всего, но не подходит пациентам с ожирением и эмфиземой легких
При исследовании обращают внимание на наличие основных диагностических признаков:
- дилатация правого желудочка и гипокинезия;
- расширение выводного отдела;
- фиброзные изменения;
- конечные диастолические аневризмы;
- акинез-дискинез внутриполостного сегмента и верхушки правого желудочка;
- верхушечные трабекулы (выпячивания в просвет).
- Контрастная ангиография правого желудочка считается «золотым стандартом», но мало применяется из-за инвазивности. Техника позволяет области истощения и расширения миокарда в анатомическом треугольнике дисплазии.
- Компьютерная томография позволяет увидеть жировые отложения в миокарде и эпикарде, трабекуляции с медленным затуханием, расширенный гипокинетический правый желудочек, зубчатых образований на стенке правого желудочка. КТ применяется редко из-за высокой радиационной нагрузки.
- Магнитно-резонансная томография позволяет проводить трехмерную оценку желудочковой анатомии, объемов. Методика распознает замену мышечных волокон жировой и фиброзной тканью. Хотя жировая инфильтрация присутствует у более 50% пожилых людей. Наличие трансмурального жирового замещения или диффузного истончения миокарда правого желудочка — основные критерии диагностики.
Основные признаки АДПЖ с позиции оценки систолической и диастолической функции:
- области интенсивности высоких сигналов, указывающие на замещение миокарда жиром;
- замена фиброфата, которая приводит к диффузному истончению миокарда правого желудочка;
- аневризма правого желудочка;
- дилатация правого желудочка и расширение выходного тракта;
- региональные акинезии (участки без сокращения);
- нарушение систолы и диастолы (незначительный критерий).
Эндомиокардиальная биопсия является гистологическим обследованиям, результаты которого сомнительны из-за сегментарного характера. Чаще всего ткани берут из сердечной перегородки. К осложнениям процедуры относится тампонада сердца и перфорация.
Описание патологического процесса
О развитии дисплазии говорят, если во влагалищной части эпителия матки наблюдаются атипические изменения. При своевременном обнаружении заболевания, патологический процесс удается полностью остановить. Если же отказываться от терапии, на шейке матки начинаются необратимые предраковые процессы. Возникает серьезная угроза для жизни пациентки.
К сожалению, на ранней стадии заболевания дисплазия может никак себя не проявлять. Надежным методом профилактики являются регулярные (не реже раза в 6 месяцев) осмотры у гинеколога.

Патологический процесс затрагивает клеточные структуры слизистой названного органа, в отличие от эрозии, при которой поражение связано чаще с механическим повреждением. Заболевание чаще всего диагностируется у женщин детородного возраста. Статистика показывает, что тяжелая дисплазия матки встречается у одной женщины на тысячу. Недуг может также приводить к неизлечимому бесплодию.
CIN 3 (дисплазия тяжелой степени)
Дисплазия тяжелой степени или CIS (карцинома in situ) формируется в 30 — 50% случаев. Поражается 2/3 эпителиального пласта. Почти все клетки выглядят как злокачественные. Поверхностный слой и строма (соединительно- тканная основа) в патологический процесс не вовлекаются.
Отмечаются выраженные морфологические изменения:
- Клетки располагаются неравномерно, изменяется толщина слоев.
- Изменяются форма и размер клеток, они приобретают овальную или неправильную форму, некоторые из них становятся больших размеров.
- Выявляется все большее количество клеток с огромными гиперхромными ядрами. В ядрах выявляются единичные митозы. Контуры ядер волнистые, четкие.
При CIN III регрессия патологического процесса наблюдается в 32% случаев. Переход CIN 3 в рак шейки матки наблюдается в 12 — 32% случаев, при инфицировании ВПЧ высокого онкогенного риска — в 12% случаев в течение первых 2-х лет.

Рис. 7. Цитологическое исследование. CIN-3 — CIS (дисплазия тяжелой степени или карцинома in situ).

Рис. 8. Гистологическое исследование. На фото показаны изменения в эпителиальном слое при дисплазии — нарастание количества атипичных клеток от CIN 1 до CIN 3.

Рис. 9. Цитологическое исследование. На фото показан процесс нарушения дифференцировки эпителиальных клеток по мере нарастания степени дисплазии.
По сути цервикальная интраэпителиальная неоплазия (СIN) и плоскоклеточный рак шейки матки — это единый патологический процесс.
Симптомы патологии
Первые признаки заболевания дают о себе знать, как правило, уже в подростковом возрасте. Наиболее распространенные симптомы: аритмия желудочков, желудочковая экстрасистолия (лишние сокращения), случаи фибрилляции желудочков (несогласованность сокращений). Гораздо реже встречаются случаи фибрилляции и трепетания предсердий.
Типичны жалобы на боль в грудине, приступы тахикардии, одышку, головокружение, синкопальные состояния (внезапную кратковременную потерю сознания с потерей мышечного тонуса). В запущенных случаях происходит формирование правожелудочковой сердечной недостаточности (СН) с типичным комплексом симптомов: отеками, застоем венозной крови, асцитом. При этом СН может и не сопровождаться сбоями в сердечном ритме.
При бессимптомной форме правожелудочковая КМП никак не влияет на самочувствие пациента и не обнаруживается при электрокардиографических исследованиях. В то время как у одних заболевание развивается на протяжении долгих лет, у других развитие бессимптомной формы АКМП до СН происходит за несколько недель.

При любой форме заболевания и на любом из его этапов существует опасность летального исхода в результате фибрилляции желудочков. Нередким провоцирующим фактором этого оказываются занятия спортом или другие физические нагрузки. Также к смерти приводит молниеносный вирусный миокардит и аномалия Уля (выраженная гипоплазия правого желудочка).
Патогенез
При АКМП миокард правого желудочка лишается мышечных клеток, которые заменяются липидной и фиброзной тканью. На начальной стадии патологического процесса стенки желудочка утолщаются, но после постепенно утончаются вплоть до возникновения аневризм небольших размеров.
На ранних стадиях болезни изменение миокарда имеет локальный, ограниченный характер. Со временем поражение полностью захватывает ткани правого желудочка целиком, частично затрагивая левый. При выраженном характере поражения левого желудочка развивается увеличение его объема, аневризмы стенок. В редких случаях перерождение происходит и в межжелудочковой перегородке. Однако изменения незначительны, так как в структуре перегородки отсутствует эпикард, с которого начинается патологический процесс.

Поначалу болезнь не дает о себе знать проявлением каких-либо симптомов. Однако так как пораженные ткани не способны проводить электрические импульсы, функционирование сердечной мышцы постепенно приходит в беспорядок. По мере увеличения патологических очагов ухудшается способность правого желудочка перекачивать кровь, что приводит к увеличению камер правого сердца и систолической дисфункции.
Этапы развития заболевания
Заболевание может затрагивать различные слои клеток эпителия матки. В зависимости от глубины патологического процесса, выделяют три степени дисплазии:
- Легкая форма характеризуется незначительными изменениями слизистой. Затрагивается нижняя треть эпителия органа.
- При появлении изменений в нижней и средней трети эпителия говорят об умеренной дисплазии.
- Если поражение затрагивает все слои эпителия клеток, ставят диагноз «тяжелая дисплазия». Такое состояние считается очень опасным, при нем высок риск онкологических осложнений.
При тяжелой дисплазии не затрагиваются сосуды, нервные окончания, мышцы, как при раке матки, однако отсутствие полноценного лечения приведет к стремительному прогрессированию заболевания.
В норме клетки эпителия матки имеют правильную круглую форму. При развитии патологического процесса клетки становятся плоскими, а сам эпителий – бесформенным, со множественными ядрами. Во время проведения исследования сложно отличить края отдельных слоев.
Что провоцирует / Причины аритмогенной дисплазии правого желудочка:
Наследственная этиология подтверждается в 30% случаев АДПЖ. За исключением нескольких семей при АДПЖ наследование осуществляется по аутосомно-доминантному типу. Мутации в гене, ответственном за рианодиновый рецептор, найдены в четырех различных семьях в Северной Италии. Рианодиновый рецептор, являясь внутриклеточным кальциевым каналом, расположенным на мембране саркоплазматического ретикулума, играет ключевую роль в сопряжении возбуждения и сокращения мышцы сердца. Он контролирует выход кальция из саркоплазматического ретикулума в цитоплазму.
Дефект этого рецептора ведет к нарушению кальциевого гомеостаза с последующей гибелью кардиомиоцитов.В семьях с аутосомно-рецессивным типом наследования АДПЖ сочетается с пальмаплантарной кератодермией и изменениями волос в виде «шерстяных волос». Данная форма заболевания носит название – болезнь Naxos. Она была описана в 18 случаях среди лиц, проживающих на греческом острове Naxos. Молекулярный анализ показал дефект в гене, ответственном за плакоглобин в одной семье и за десмоглобин в трех семьях. Плакоглобин и десмоглобин являются протеинами, поддерживающими связь десмосомальных клеток. Нарушение функции десмосом может вести к гибели кардиомиоцитов под воздействием механического стресса.
Гены, ответственные за АДПЖ, не до конца идентифицированы, однако выявлено сцепление данного заболевания с 7 локусами, картированными на 1, 3, 10 и 14 хромосомах. В таблице 1 представлены типы АДПЖ в зависимости от генетического дефекта. Семьи с двумя и более больными АДПЖ были выявлены в Азии, Японии, Северной Европе, Африке и Северной Америке. В настоящее время еще не разработано рутинного теста для ДНК-диагностики АДПЖ. Генетическое консультирование пациентов с АДПЖ подразумевает обследование всех членов их семей на предмет наличия у них данной патологии.В дополнение к наследственной теории имеются дисонтогенетическая, дегенеративная, инфекционная или воспалительная, апоптотическая теории, а также теория трансдифференцировки кардиомиоцитов. Дисонтогенетическая теория в большей степени является исторической.
АДПЖ является формой «пергаментного ПЖ» или аномалии Уля. В основе дегенеративной теории АДПЖ лежит положение о гибели кардиомиоцитов вследствие метаболического или ультраструктурного наследственного дефекта. Возможный дефект был картирован на 14 хромосоме (14q23-q24). Эта область кодирует ген, ответственный за a-актин, который структурно гомологичен с концевым доменом дистрофина. Эта находка подтверждала теорию о генетически детерминированной атрофии, сходной с таковой при амиотрофии Дюшена или мышечной дистрофии Беккера. Некоторые авторы предлагали определять АДПЖ, как «миокардиальную дистрофию». В дальнейшем был описан случай АДПЖ в шведской семье с вовлечением скелетных мышц со сцеплением с 10 хромосомой (10q22.3). Инфекционная или воспалительная теория полагает, что в основе АДПЖ лежит миокардит. Воспалительная инфильтрация является частой гистологической находкой при АДПЖ. Fontaine G. с соавторами нашли воспалительные инфильтраты у 8 из 27 пациентов с АДПЖ.
У трансгенных мышей, инфицированных вирусом Коксаки В3, развивалась селективная гибель кардиомиоцитов ПЖ, острая мононуклеарная клеточная инфильтрация с формированием аневризмы ПЖ. В дальнейшем энтеровирусная РНК, гомологичная вирусу Коксаки тип В, найдена у 3 из 8 пациентов с АДПЖ и у 7 из 23 пациентов с миокардитом или ДКМП. Апоптотическая теория подтверждена выявлением апоптоза и высокого уровня протеаз, необходимых для апоптоза, в миокарде ПЖ у 6 из 8 пациентов с АДПЖ по сравнению с контрольными образцами без патологии сердца. Теория трансдифференцировки кардиомиоцитов основана на гипотезе возможности перерождения миокардиальных клеток из мышечных в жировые и обнаружении клеток, экспрессирующих десмин, как промежуточных между мышечными и жировыми клетками.